28 SEPT 2011
Kimia (dari bahasa Farsi dan bahasa Indo-Eropa کیمیا / kimia "seni transformasi" "alkimia") adalah ilmu yang mempelajari mengenai komposisi, struktur, dan sifat zat atau materi dari skala atom hingga molekul
serta perubahan atau transformasi serta interaksi mereka untuk
membentuk materi yang ditemukan sehari-hari. Kimia juga mempelajari
pemahaman sifat dan interaksi atom individu dengan tujuan untuk menerapkan pengetahuan tersebut pada tingkat makroskopik. Menurut kimia modern, sifat fisik materi umumnya ditentukan oleh struktur pada tingkat atom yang pada gilirannya ditentukan oleh gaya antaratom dan ikatan kimia.
Pengantar
Kimia sering disebut sebagai "ilmu pusat" karena menghubungkan berbagai ilmu lain, seperti fisika, ilmu bahan, nanoteknologi, biologi, farmasi, kedokteran, bioinformatika, dan geologi. Koneksi ini timbul melalui berbagai subdisiplin yang memanfaatkan konsep-konsep dari berbagai disiplin ilmu. Sebagai contoh, kimia fisik melibatkan penerapan prinsip-prinsip fisika terhadap materi pada tingkat atom dan molekul.
Kimia berhubungan dengan interaksi materi yang dapat melibatkan dua zat atau antara materi dan energi, terutama dalam hubungannya dengan hukum pertama termodinamika. Kimia tradisional melibatkan interaksi antara zat kimia dalam reaksi kimia, yang mengubah satu atau lebih zat menjadi satu atau lebih zat lain. Kadang reaksi ini digerakkan oleh pertimbangan entalpi, seperti ketika dua zat berentalpi tinggi seperti hidrogen dan oksigen elemental bereaksi membentuk air, zat dengan entalpi lebih rendah. Reaksi kimia dapat difasilitasi dengan suatu katalis, yang umumnya merupakan zat kimia lain yang terlibat dalam media reaksi tapi tidak dikonsumsi (contohnya adalah asam sulfat yang mengkatalisasi elektrolisis air) atau fenomena immaterial (seperti radiasi elektromagnet dalam reaksi fotokimia). Kimia tradisional juga menangani analisis zat kimia, baik di dalam maupun di luar suatu reaksi, seperti dalam spektroskopi.
Semua materi normal terdiri dari atom atau komponen-komponen subatom yang membentuk atom; proton, elektron, dan neutron. Atom dapat dikombinasikan untuk menghasilkan bentuk materi yang lebih kompleks seperti ion, molekul, atau kristal. Struktur dunia yang kita jalani sehari-hari dan sifat materi yang berinteraksi dengan kita ditentukan oleh sifat zat-zat kimia dan interaksi antar mereka. Baja lebih keras dari besi karena atom-atomnya terikat dalam struktur kristal yang lebih kaku. Kayu terbakar atau mengalami oksidasi cepat karena ia dapat bereaksi secara spontan dengan oksigen pada suatu reaksi kimia jika berada di atas suatu suhu tertentu.
Zat cenderung diklasifikasikan berdasarkan energi, fase, atau komposisi kimianya. Materi dapat digolongkan dalam 4 fase, urutan dari yang memiliki energi paling rendah adalah padat, cair, gas, dan plasma. Dari keempat jenis fase ini, fase plasma hanya dapat ditemui di luar angkasa yang berupa bintang, karena kebutuhan energinya yang teramat besar. Zat padat memiliki struktur tetap pada suhu kamar yang dapat melawan gravitasi atau gaya lemah lain yang mencoba mengubahnya. Zat cair memiliki ikatan yang terbatas, tanpa struktur, dan akan mengalir bersama gravitasi. Gas tidak memiliki ikatan dan bertindak sebagai partikel bebas. Sementara itu, plasma hanya terdiri dari ion-ion yang bergerak bebas; pasokan energi yang berlebih mencegah ion-ion ini bersatu menjadi partikel unsur. Satu cara untuk membedakan ketiga fase pertama adalah dengan volume dan bentuknya: kasarnya, zat padat memeliki volume dan bentuk yang tetap, zat cair memiliki volume tetap tapi tanpa bentuk yang tetap, sedangkan gas tidak memiliki baik volume ataupun bentuk yang tetap.

Ilmuwan yang mempelajari kimia sering disebut kimiawan. Sebagian besar kimiawan melakukan spesialisasi dalam satu atau lebih subdisiplin. Kimia yang diajarkan pada sekolah menengah sering disebut "kimia umum" dan ditujukan sebagai pengantar terhadap banyak konsep-konsep dasar dan untuk memberikan pelajar alat untuk melanjutkan ke subjek lanjutannya. Banyak konsep yang dipresentasikan pada tingkat ini sering dianggap tak lengkap dan tidak akurat secara teknis. Walaupun demikian, hal tersebut merupakan alat yang luar biasa. Kimiawan secara reguler menggunakan alat dan penjelasan yang sederhana dan elegan ini dalam karya mereka, karena terbukti mampu secara akurat membuat model reaktivitas kimia yang sangat bervariasi.
Ilmu kimia secara sejarah merupakan pengembangan baru, tapi ilmu ini berakar pada alkimia yang telah dipraktikkan selama berabad-abad di seluruh dunia.
Sejarah
Alkimiawan menemukan banyak proses kimia yang menuntun pada pengembangan kimia modern. Seiring berjalannya sejarah, alkimiawan-alkimiawan terkemuka (terutama Abu Musa Jabir bin Hayyan dan Paracelsus) mengembangkan alkimia menjauh dari filsafat dan mistisisme dan mengembangkan pendekatan yang lebih sistematik dan ilmiah. Alkimiawan pertama yang dianggap menerapkan metode ilmiah terhadap alkimia dan membedakan kimia dan alkimia adalah Robert Boyle (1627–1691). Walaupun demikian, kimia seperti yang kita ketahui sekarang diciptakan oleh Antoine Lavoisier dengan hukum kekekalan massanya pada tahun 1783. Penemuan unsur kimia memiliki sejarah yang panjang yang mencapai puncaknya dengan diciptakannya tabel periodik unsur kimia oleh Dmitri Mendeleyev pada tahun 1869.
Penghargaan Nobel dalam Kimia yang diciptakan pada tahun 1901 memberikan gambaran bagus mengenai penemuan kimia selama 100 tahun terakhir. Pada bagian awal abad ke-20, sifat subatomik atom diungkapkan dan ilmu mekanika kuantum mulai menjelaskan sifat fisik ikatan kimia. Pada pertengahan abad ke-20, kimia telah berkembang sampai dapat memahami dan memprediksi aspek-aspek biologi yang melebar ke bidang biokimia.
Industri kimia mewakili suatu aktivitas ekonomi yang penting. Pada tahun 2004, produsen bahan kimia 50 teratas global memiliki penjualan mencapai 587 bilyun dolar AS dengan margin keuntungan 8,1% dan pengeluaran riset dan pengembangan 2,1% dari total penjualan.
Cabang ilmu kimia

Lima Cabang Utama:
- Kimia analitik adalah analisis cuplikan bahan untuk memperoleh pemahaman tentang susunan kimia dan strukturnya. Kimia analitik melibatkan metode eksperimen standar dalam kimia. Metode-metode ini dapat digunakan dalam semua subdisiplin lain dari kimia, kecuali untuk kimia teori murni.
- Biokimia mempelajari senyawa kimia, reaksi kimia, dan interaksi kimia yang terjadi dalam organisme hidup. Biokimia dan kimia organik berhubungan sangat erat, seperti dalam kimia medisinal atau neurokimia. Biokimia juga berhubungan dengan biologi molekular, fisiologi, dan genetika.
- Kimia anorganik mengkaji sifat-sifat dan reaksi senyawa anorganik. Perbedaan antara bidang organik dan anorganik tidaklah mutlak dan banyak terdapat tumpang tindih, khususnya dalam bidang kimia organologam.
- Kimia organik mengkaji struktur, sifat, komposisi, mekanisme, dan reaksi senyawa organik. Suatu senyawa organik didefinisikan sebagai segala senyawa yang berdasarkan rantai karbon.
- Kimia fisik mengkaji dasar fisik sistem dan proses kimia, khususnya energitika dan dinamika sistem dan proses tersebut. Bidang-bidang penting dalam kajian ini di antaranya termodinamika kimia, kinetika kimia, elektrokimia, mekanika statistika, dan spektroskopi. Kimia fisik memiliki banyak tumpang tindih dengan fisika molekular. Kimia fisik melibatkan penggunaan kalkulus untuk menurunkan persamaan, dan biasanya berhubungan dengan kimia kuantum serta kimia teori.
- Kimia Material menyangkut bagaimana menyiapkan, mengkarakterisasi, dan memahami cara kerja suatu bahan dengan kegunaan praktis.
- Kimia teori adalah studi kimia melalui penjabaran teori dasar (biasanya dalam matematika atau fisika). Secara spesifik, penerapan mekanika kuantum dalam kimia disebut kimia kuantum. Sejak akhir Perang Dunia II, perkembangan komputer telah memfasilitasi pengembangan sistematik kimia komputasi, yang merupakan seni pengembangan dan penerapan program komputer untuk menyelesaikan permasalahan kimia. Kimia teori memiliki banyak tumpang tindih (secara teori dan eksperimen) dengan fisika benda kondensi dan fisika molekular.
- Kimia nuklir mengkaji bagaimana partikel subatom bergabung dan membentuk inti. Transmutasi modern adalah bagian terbesar dari kimia nuklir dan tabel nuklida merupakan hasil sekaligus perangkat untuk bidang ini.
- Kimia Organik Bahan Alam mempelajari senyawa organik yang disintesis secara alami oleh alam, khususnya makhluk hidup.
Konsep dasar
Tatanama

Atom
Atom adalah suatu kumpulan materi yang terdiri atas inti yang bermuatan positif, yang biasanya mengandung proton dan neutron, dan beberapa elektron di sekitarnya yang mengimbangi muatan positif inti. Atom juga merupakan satuan terkecil yang dapat diuraikan dari suatu unsur dan masih mempertahankan sifatnya, terbentuk dari inti yang rapat dan bermuatan positif dikelilingi oleh suatu sistem elektron.Unsur

Ion
Ion atau spesies bermuatan, atau suatu atom atau molekul yang kehilangan atau mendapatkan satu atau lebih elektron. Kation bermuatan positif (misalnya kation natrium Na+) dan anion bermuatan negatif (misalnya klorida Cl−) dapat membentuk garam netral (misalnya natrium klorida, NaCl). Contoh ion poliatom yang tidak terpecah sewaktu reaksi asam-basa adalah hidroksida (OH−) dan fosfat (PO43−).Senyawa
Senyawa merupakan suatu zat yang dibentuk oleh dua atau lebih unsur dengan perbandingan tetap yang menentukan susunannya. sebagai contoh, air merupakan senyawa yang mengandung hidrogen dan oksigen dengan perbandingan dua terhadap satu. Senyawa dibentuk dan diuraikan oleh reaksi kimia.Molekul
Molekul adalah bagian terkecil dan tidak terpecah dari suatu senyawa kimia murni yang masih mempertahankan sifat kimia dan fisik yang unik. Suatu molekul terdiri dari dua atau lebih atom yang terikat satu sama lain.Zat kimia
Suatu 'zat kimia' dapat berupa suatu unsur, senyawa, atau campuran senyawa-senyawa, unsur-unsur, atau senyawa dan unsur. Sebagian besar materi yang kita temukan dalam kehidupan sehari-hari merupakan suatu bentuk campuran, misalnya air, aloy, biomassa, dll.Ikatan kimia

Wujud zat
Fase adalah kumpulan keadaan sebuah sistem fisik makroskopis yang relatif serbasama baik itu komposisi kimianya maupun sifat-sifat fisikanya (misalnya masa jenis, struktur kristal, indeks refraksi, dan lain sebagainya). Contoh keadaan fase yang kita kenal adalah padatan, cair, dan gas. Keadaan fase yang lain yang misalnya plasma, kondensasi Bose-Einstein, dan kondensasi Fermion. Keadaan fase dari material magnetik adalah paramagnetik, feromagnetik dan diamagnetik.Reaksi kimia

Kimia kuantum
Kimia kuantum secara matematis menjelaskan kelakuan dasar materi pada tingkat molekul. Secara prinsip, dimungkinkan untuk menjelaskan semua sistem kimia dengan menggunakan teori ini. Dalam praktiknya, hanya sistem kimia paling sederhana yang dapat secara realistis diinvestigasi dengan mekanika kuantum murni dan harus dilakukan hampiran untuk sebagian besar tujuan praktis (misalnya, Hartree-Fock, pasca-Hartree-Fock, atau teori fungsi kerapatan, lihat kimia komputasi untuk detilnya). Karenanya, pemahaman mendalam mekanika kuantum tidak diperlukan bagi sebagian besar bidang kimia karena implikasi penting dari teori (terutama hampiran orbital) dapat dipahami dan diterapkan dengan lebih sederhana.Dalam mekanika kuantum (beberapa penerapan dalam kimia komputasi dan kimia kuantum), Hamiltonan, atau keadaan fisik, dari partikel dapat dinyatakan sebagai penjumlahan dua operator, satu berhubungan dengan energi kinetik dan satunya dengan energi potensial. Hamiltonan dalam persamaan gelombang Schrödinger yang digunakan dalam kimia kuantum tidak memiliki terminologi bagi putaran elektron.
Penyelesaian persamaan Schrödinger untuk atom hidrogen memberikan bentuk persamaan gelombang untuk orbital atom, dan energi relatif dari orbital 1s, 2s, 2p, dan 3p. Hampiran orbital dapat digunakan untuk memahami atom lainnya seperti helium, litium, dan karbon.
Hukum kimia
Hukum-hukum kimia sebenarnya merupakan hukum fisika yang diterapkan dalam sistem kimia. Konsep yang paling mendasar dalam kimia adalah Hukum kekekalan massa yang menyatakan bahwa tidak ada perubahan jumlah zat yang terukur pada saat reaksi kimia biasa. Fisika modern menunjukkan bahwa sebenarnya energilah yang kekal, dan bahwa energi dan massa saling berkaitan. Kekekalan energi ini mengarahkan kepada pentingnya konsep kesetimbangan, termodinamika, dan kinetika.Industri Kimia
Industri kimia adalah salah satu aktivitas ekonomi yang penting. Top 50 produser kimia dunia pada tahun 2004 mempunyai penjualan sebesar USD $587 milyar dengan profit margin sebesar 8.1% dan penegluaran rekayasa (research and development) sebesar 2.1% dari total penjualan kimia.
Cairan adalah salah satu dari empat fase benda yang volumenya tetap dalam kondisi suhu dan tekanan
tetap; dan, bentuknya ditentukan oleh wadah penampungnya. Cairan juga
melakukan tekanan kepada sisi wadahnya dan juga kepada benda yang
terdapat dalam cairan tersebut; tekanan ini disalurkan ke seluruh arah.
Hydrostatik
Tekanan
Tekanan hydrostatik
Bila cairan itu diam dalam medan gravitasi yang sama, tekanan p dalam titik tertentu adalah
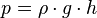 , satuan SI : Pascal: N/m²=kg/ms²
, satuan SI : Pascal: N/m²=kg/ms²
dimana ρ adalah "densitas" dari cairan (dianggap tetap) dan z
adalah kedalaman titik tersebut di bawah permukaan. Catatan, formula
ini menganggap tekanan pada permukaan adalah nol, relatif terhadap
ketinggian permukaan.
Tekanan piston atau tekanan hydrolik
Jika permukaan suatu zat cair ditekan dari luar, maka tekanan ini
akan bergerak dikarenakan sifat cairan yang flexibel ke segala arah
dengan kekuatan yang sama. Rumus:  . oder
. oder  .
.
 . oder
. oder  .
.Gaya Dorong atau Prinsip Archimedes
Sebagai gaya dorong (Fd) dimaksudkan berat yang "hilang", yang
dialami sebuah benda bila benda tersebut diletakkan di atas air. Besar
suatu gaya dorong adalah sama besarnya dengan jumlah suatu cairan yang
ditekan oleh benda tersebut. Atau dengan kata lain, gaya dorong
tergantung dari massa jenis cairan tersebut dan volumenya, sedangkan
gaya tekan ke bawah oleh benda di air juga tergantung massa jenis benda
tersebut serta volumenya. Dimana arah gaya dorong ke atas sedangkan
berat benda(G) yang menekan cairan ke bawah sesuai arah gravitasi.
Percepatan (a) yang dilakukan cairan yang ditekan sama besarnya dengan
percepatan gravitasi (g], sehingga yang memainkan peranan apakah suatu
benda mengapung, melayang, atau tenggelam adalah massa jenis benda dan
zat cair serta volume benda dan zat cair. Sesuai hukum Archimedes maka
dapat kita katakan ada 3 hal yang dapat terjadi: a. Mengapung bila G<
Fd, massa jenis benda tersebut < massa jenis cairan
b. Melayang bila G=Fd, massa jenis benda tersebut = massa jenis cairan
c. Tenggelam bila G>Fd, massa jenis benda tersebut > massa jenis cairan
Contoh 1: Sebuah benda mempunyai massa m= 2 kg dan volume v=800cm³.
Benda ini melayang di arir dan tergantung di sebuah pegas (g=10cm/s²).
Kemudian tampak pada pegas digital tersebut gaya sebesar 12 N. Buktikan
G = m.a = m.g = 2.10N
Fd = rho.V.g = 0,0008.1000.10N = 8N
Berat tersisa yang ditahan oleh pegas = G − Fd = 20 − 8N = 12N
Contoh 2: Sebuah Balok dengan sisi a= 10cm , b = 15 cm , c = 20cm
dengan massa 1 kg, berada di dalam air yang bersuhu T=4 °C. Dalam
keseimbangan benda tersebut tampak sepertiga dari volume benda tersebut
diam di dalam air. Maka, Fd = rho.V.g = 0,003.100.1 = 0,3N G = Fd / 3 = 0,1N
Hydrodynamik
Viskositas, laminar dan turbulent flow
Viskositas
adalah suatu besaran yang menggambarkan sifat kelekatan dari zat cair
atau pun gas. Contohnya minyak mempunyai viskositas yang besar. Sebagai
standard air diberikan viskositas 1. Darah mempunyai nilai viskositas tertentu;bilamana nilai viskositasnya sangat tinggi dapat menimbulkan bahaya trombose.
Gaya antarmolekul, tegangan permukaan dan Kapillaritas
Gaya antarmolekul atau Ikatan Van der Waals
Ikatan Van der Waals adalah istilah umum untuk gaya yang terjadi di antara molekul baik pada zat padat, zat cair, ataupun gas. Pada zat padat dan zat cair gaya ini menentukan besarnya volume Dari tipe efeknya dapat dibedakan menjadi= Kohesi, jika gaya tarik terjadi di antara molekul suatu benda yang sejenis. Akibat dari Kohesi adalah yang dinamakan tegangan permukaaan. Adhesi adalah gaya tarik menarik yang timbul di antara molekul2 yang berbeda. Daya serap adalah gaya adhesi yang timbul antara molekul zat padat dengan zat cair atau zat padat dan gas.
Tegangan permukaan dan Kapilaritas
Bentuk suatu materi dipisahkan satu sama lain oleh lapisan
pembatasnya.Lapisan pembatas menunjukkan sifat yang spesial. Cairan
memiliki tegangan permukaan dan kapilaritas
Dalam
suatu zat cair adalah gaya antar molekul sama besar ke segala arah ,
sehingga mereka saling menetralkan. Pada suatu permukaan molekul zat
padat ada tegangan pada yang menguasai permukaannnya dengan arah gaya ke
dalam molekul tersebut. Sebagai contoh alveolus.
Tegangan permukaan mengakibatkan pengurangan atau reduksi dari
permukaan suatu molekul atau dengan kata lain molekul mempunyai
kecenderungan untuk mengecil. Pada molekul air tegangan ini dikarenakan ikatan hydrogen maka molekul air mempunyai bentuk seperti bola. Baik Deterjen ataupun zat kotor dapat menurunkan tegangan permukaan air. Prinsip dari zat pembersih deterjen. Kapillaritas adalah suatu daya tarik ke atas atau ke bawah yang dialami zat cair bila zat cair tersebut berada dalam suatu pipa kapillar.
air kiri air raksa kanan
Contoh yang paling umum adalah air (kiri) di dalam gelas yang
tertarik ke atas oleh sebuah pipa kapillar. Ini dapat dijelaskan karena
gaya adhesi (gaya tarik antara molekul air dan pipa kapillar) lebih
besar dari gaya kohesi(antar molekul air saja). Pada air raksa (kanan)
gaya kohesi (tarik menarik anatar molekul air raksa lebih besar) dari
gaya adhesi(tarik menarik antar molekul air raksa dan molekul pipa
kapillar)
Titik didih, titik beku
Cairan biasanya mengembang bila dipanasi dan menyusut bila didinginkan.
Cairan pada titik didih tertentu berubah menjadi gas, dan pada titik bekunya, berubah menjadi padat. Melalui distilasi bertingkat, cairan dapat dipisahkan satu dengan lainnya karena masing-masing menguap pada titik didih tersendiri.
Lihat pula
| Dari | Ke | ||||||||
| Padat | Cair | Gas | Plasma | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Padat | N/A | Mencair | Menyublim | - | |||||
| Cair | Membeku | N/A | Menguap | - | |||||
| Gas | Mengkristal | Mengembun | N/A | Ionisasi | |||||
| Plasma | - | - | Rekombinasi/Deionisasi | N/A | |||||
Tidak ada komentar:
Posting Komentar